ژن هاي هانتينگتين جهش يافته نه تنها باعث توليد مواد سمي در مغز و از بين رفتن بافت عصبي مي شوند بلكه همچنين باعث مي شوند كه ماده مورد نياز رشد عصبي (BDNF) نيز به اندازه كافي در بافت مغز توليد نشود
النا كاتانئو، دوروتي ريگامونتي و چيرا زوكاتو

ترجمه: زينب همتي
همه چيز با يك نگاه مبهوت آغاز مي شود. گيجي و سردرگمي به ويژه هنگامي كه استرس رواني و فيزيكي در كار باشد بيشتر مي شود و به نمايش حالت هاي غيرارادي منتهي مي شود. با توسعه بيماري حركات رقص مانند كه ممكن است با رفتارهاي مستانه اشتباه گرفته شود زيادتر مي شود. افراد قابليت هاي خود را در ارائه كارهاي معمول روزمره از دست مي دهند و نشانه هايي از نقص توانايي هاي ذهني از خود به نمايش مي گذارند. در مراحل بعدي افسردگي و خشونت بروز كرده و در حالات بسيار شديد، جنون و پريشاني بر بيمار غلبه مي كند. اين بيمار مي تواند انسان سالم يا عضوي از يك خانواده را تبديل به موجودي زمين گير و ذليل نمايد كه همچون يك سايه زندگي محدود به بستر بيماري دارد.
اين تصويري منحوس از بيماري هانتينگتون است. بيماري اي كه منشاء توارثي داشته و معمولا در سال هاي دهه سوم و چهارم زندگي گريبان بيماران را مي گيرد. هيچ گونه راه علاجي براي اين بيماري وجود ندارد. بنابراين بيماري به آرامي گسترش يافته و عموما بعد از ۱۵ تا ۲۰ سال به فلج شدن شخص و مرگ منتهي مي شود. اگرچه اين بيماري مقدمتا به سيستم اعصاب مركزي حمله مي كند وليكن غالب بيماران از پيچيدگي هاي حاصله در قلب و عروق و يا صدمات وارده بر سر به خاطر سقوط هاي مكرر مي ميرند.
ژن عامل اين بيماري در سال ۱۹۹۳ توسط ۵۸ دانشمند از سراسر جهان كشف شد. كمي بعد روش هاي آزمايشگاهي براي كشف عامل ژنتيكي اين بيماري توسعه يافت و افرادي كه در خانواده خود چنين بيماراني داشتند توانستند دريابند كه آيا اين ژن جهش يافته را در خود دارند يا خير؟ از آنجا كه اين ژن غالب است همه حاملان آن به بيماري مبتلا شده و با احتمال ۵۰ درصد اين ژن را به فرزندان خود منتقل مي كنند. برخي افراد ترجيح مي دهند كه اين آزمايش را صورت داده و در صورت مثبت بودن آن براي بقيه عمر خود برنامه ريزي كنند. برخي ديگر ترجيح مي دهند چيزي در اين مورد ندانند. دانشمندان سعي مي كنند به اعضاي خانواده هايي كه چنين بيماراني دارند اميد ببخشند و راه هايي بيابند تا از طريق آنها شناخت بيشتري در مورد اين بيماري به دست آورده و چگونگي جلوگيري از عملكرد اين ژن را مشخص كنند. اكنون شواهدي به دست آمده است كه نشان مي دهد موتاسيوني كه اين بيماري را به وجود مي آورد همچون يك شيشه دولبه عمل مي كند. در فرآيند توسعه بيماري نه تنها يك پروتئين ايجاد مي شود كه ظاهرا بر روي سلول هاي عصبي تاثيرات سمي دارد بلكه اين پروتئين از توليد يك عامل رشد، ممانعت به عمل آورده و از اين طريق يك بخش مغز را معيوب مي سازد. آزمايش هاي صورت گرفته بر روي حيوانات و همچنين تجارب اوليه براي بيماران در مراحل اوليه اين بيماري نشان داده است كه درمان از طريق عوامل تشويق كننده رشد مي تواند تاثيراتي بر بيماران داشته باشد. اين يافته هاي جديد تنها ۵ بخش از پيچيدگي هاي مربوط به نحوه عملكرد اين بيماري را مشخص ساخته و بدون شك مطالعات بيشتري لازم است تا شناخت دانشمندان در اين زمينه كامل شود. بيماري هانتينگتون نام خود را از يك پزشك به نام جورج هانتينگتون (G. Huntington) در اوهايو گرفته است. در سال ۱۸۶۲ اين پزشك و پدر او كه يك پزشك بود گزارش هاي دقيقي در مورد يك بيماري كه در يك خانواده در لانگ آيسلند نيويورك زندگي مي كردند تهيه كردند. اين پزشك در ابتدا به لحاظ رفتار ناموزون بيماران خود نام بيماري را كره (Chorea) نهاد. اين لغت از كلمه يوناني كروس (Choros) به معناي رقص گرفته شده است. در حال حاضر پزشكان مي دانند كه بيماري هانتينگتون يكي از شايع ترين بيماري هاي ارثي مغزي است و در هر ۱۰ هزار نفر، يك نفر ممكن است به اين بيماري مبتلا شود.
عوارض اين بيماري وقتي ظاهر مي شود كه سلول ها و نورون هاي موجود در ناحيه استرياتوم (Striatum) تخريب مي شوند. استرياتوم بخشي از ساختمان مغز است كه به آن گانگليون مركزي گفته مي شود. اين سلول ها معمولا وظيفه شان آن است كه علائم ناشي از هيجان را كه از كورتكس حركتي (Motor Cortex) دريافت مي كنند از كار بيندازند. وقتي اين سلول ها مي ميرند كورتكس، فعال شده و موجب حركات ماهيچه اي غيرقابل كنترل مي شود. ژن جهش يافته در بيماري هانتينگتون، هانتينگتين دوبله شده (Dobbed Huntingtin) نام داشته و بر روي كروموزوم شماره ۴ قرار دارد. پژوهشگران پس از شناسايي ژن هانتينگتين متوجه شدند كه در افراد طبيعي اين ژن توالي از سه باز سيتوزين - آدنين - گوآنين (CAG) بوده كه در حدود ۹ تا ۳۵ بار تكرار شده است. وليكن در افراد مبتلا به بيماري هانتينگتون اين توالي بسيار طويل بوده و در برخي موارد نادر حتي تا ۲۵۰ تكرار هم مي رسد. علاوه بر اين آنها متوجه شدند كه در افراد بيماري كه تكرار اين توالي بازي بسيار زياد است، بيماري در سال هاي اوليه عمر ظاهر مي شود. به دلايلي كه هنوز شناخته شده نيست تعداد دفعات تكرار اين توالي بازي CAG در خانواده هايي كه بيمار مبتلا به هانتينگتون دارند مي تواند از نسلي به نسل ديگر منتقل شود (اين مسئله به ويژه هنگامي كه ژن معيوب از پدر به فرزند منتقل مي شود بيشتر بروز مي كند).
تئوري ها
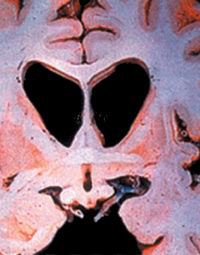
مغز فرد مبتلا به هانتينگتون
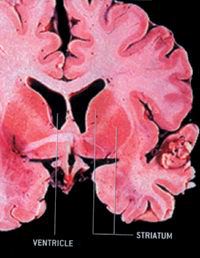
مغز فردسالم
توالي بازي سيتوزين ـ آدنين - گوآنين (CAG) اسيد آمينه گلوتامين را كه با حرف Q نشان داده مي شود كدگذاري مي كند. افراد حامل اشكال جهش يافته ژن هانتينگتين صاحب پروتئيني به هانتينگتين مي شوند. اين پروتئين از واحدهاي پلي گلوتامين كه توالي از ۳۶ واحد Q دارند تشكيل يافته است. وليكن سوال مطرح شده در اين قسمت اين است كه چرا گلوتامين هاي اضافي موجود در پروتئين موجب بيماري مي شوند؟
ساده ترين توضيحي كه در پاسخ به اين پرسش مي توان داد اين است كه يك زنجيره اضافي از پلي گلوتامين مي تواند توانايي پروتئين هانتينگتين در انجام وظايفش در مغز را مختل سازد. اين فرضيه در همان ابتداي كار كنار گذاشته شد چرا كه بررسي هاي مقدماتي مشخص ساخت كه هانتينگتين تنها در استرياتوم ساخته نمي شود - اين ناحيه از مغز در نتيجه بيماري به شدت تحليل مي رود - بلكه در قسمت هاي ديگر مغز و همچنين در نواحي اي از مغز كه به هنگام بيماري دستخوش تغيير نمي شوند نيز ساخته مي شود. به علاوه، هر فرد داراي دو كپي از هر ژن است - يكي از پدر و ديگري از ناحيه مادر بنابراين افراد مبتلا به بيماري هانتينگتون كه داراي يك نسخه سالم از اين ژن هستند قادرند مقدار مشخصي از پروتئين هانتينگتين سالم را بسازند. علاوه بر اين در افراد مبتلا به سندرم Wolf - Hirschorn (بيماري نادري است كه به علت آسيب بخش بزرگي از كروموزوم شماره ۴ ايجاد مي شود) كه صاحب يك نسخه از ژن هانتينگتين مي شوند. نسخه معيوب برداشته شده و آن بيماران به هيچ وجه علائم بيماري كره را بروز نمي دهند.
آلترناتيو ديگر، فرضيه بهره عملكرد بر اين اساس استوار است كه موتاسيون ژن هاي هانتينگتين باعث توليد برخي مواد سمي مي شود. بر اساس اين فرضيه رشته هاي بلند پلي گلوتامين كه حاصل موتاسيون ژن هانتينگتين هستند باعث به هم چسبيدن تعداد ديگري از پروتئين در مغز شده و آن را از كار مي اندازند. شيوه اتصال اين پروتئين ها مي تواند چگونگي انتقال وراثتي اين بيماري را توضيح دهد. درواقع ماكس اف. پروتز (M.F.Perutz) و همكاران او در دانشگاه كمبريج انگلستان توانستند نشان دهند كه رشته هاي توليد شده توسط ژن مولد بيماري هانتينگتون به شكل ورقه اي موسوم به ورقه بتا درمي آيد كه همچون چسبي پروتئين را به خود مي چسباند.
اينكه چگونه اين رشته ها باعث صدمات مغزي مي شوند موضوع جدل هاي پايان ناپذير متخصصين است. يك فرضيه مي گويد كه پروتئازوم ها (Proteasome) يا موادي كه عليه پروتئين هاي سمي دست به كار مي شوند قادر نيستند پروتئين توليد شده به وسيله بيماري هانتينگتون را نابود كنند. در نتيجه مواد تجمع يافته باعث نابودي سلول هاي عصبي مي شوند. وليكن اين فرضيه نمي تواند توضيح دهد كه چرا مناطق مجاور استرياتوم در مغز آسيب نمي بينند.
يك خط تحقيقاتي ديگر مشخص ساختن مولكول هايي است كه در فرآيند بيماري زايي به وسيله ژن هاي عامل اين بيماري بيان مي شوند. اگر چنانچه اين مولكول ها در شبكه پروتئيني ايجاد شده در مغز بيمار به دام بيفتند مي توانند در مقابله با آنها به كار گرفته شوند. دانشمندان تاكنون توانسته اند ۳ پروتئين را كه با شبكه مترشحه در ارتباط هستند مشخص سازند.
به منظور حل اين معما برخي از دانشمندان تلاش كرده اند تا عملكرد مواد ترشح يافته در بيمار مبتلا به هانتينگتون را مورد بررسي قرار دهند. اين تلاش ها با مهندسي ژنتيك و از طريق وارد كردن نسخه هاي اضافي از اشكال طبيعي و جهش يافته هانتينگتين به بافت هاي عصبي كشت داده شده آغاز شد. در سال ۲۰۰۰ پژوهشگران توانستند نشان دهند سلول هايي كه ژن هاي طبيعي هانتينگتين را دارا هستند مي توانند تحت شرايطي كه از بستر رشد محروم شده اند زنده بمانند. علاوه بر اين مشخص شد كه ژن طبيعي هانتينگتين مي تواند از طريق متوقف ساختن فرآيندهاي مولكولي كه منجر به مرگ برنامه ريزي شده مي شود نورون ها را زنده نگهدارد. بنابراين نتيجه منطقي اين خواهد كه هانتينگتين طبيعي پروتئيني است كه وظيفه آن حفاظت از حيات است.
گروه ديگري از دانشمندان توانستند اين يافته ها را گسترش داده و موشي را دچار تغييرات ژنتيكي كنند كه داراي نوع طبيعي و جهش يافته ژن هانتينگتين با هم باشد كه در هنگام بلوغ از كار مي افتند. اين موش ها در صورتي كه ژن هانتينگتين آنها غيرفعال مي شد دچار صدمات مغزي مي شدند.
اين گروه توانستند نشان دهند مداخله در توليد پروتئين ها در موش در مراحل مختلف مي تواند منجر به صدمات مغزي شود. به همين ترتيب آنها توانستند ثابت كنند موش هايي كه فاقد ژن هاي طبيعي هانتينگتين هستند نشانه هاي عصب شناسي مشابه آن دسته از موش هايي را دارند كه داراي ژن جهش يافته هانتينگتين هستند. آنها به اين نتيجه رسيدند كه عدم وجود ژن طبيعي هانتينگتين و حضور شكل جهش يافته آن دوروي يك سكه هستند.
مطالعات صورت گرفته در مورد موش ها نمي تواند توضيح دهد چرا سلول هاي ويژه در مغز، هدف قرار مي گيرند. در تلاش براي يافتن راه حلي براي اين معما تلاش شده است تا فاكتور نوروتروفيك مغزي يا BDNF مورد بررسي قرار گيرد. اين فاكتور ماده اي است كه براي بقا و رشد سلول هاي عصبي استرياتوم حياتي است. BDNF نوعا در كورتكس توليد شده و سپس در طول فيبرهاي عصبي، خود را به استرياتوم مي رساند. بنابراين هدف اين مطالعه بررسي ارتباط ميان هانتينگتين و BDNF است. اين بررسي ها توانست نشان دهد كه ژن طبيعي هانتينگتين موجب تشديد رشد BDNF در محيط عصبي كشت داده شده مي شود. در مقابل هانتينگتين جهش يافته به توليد BDNF كمكي نمي كند و موجب كاهش آن در مغز مي شود. علاوه بر اين در موش هايي كه مهندسي ژنتيك شده بودند ترشح BDNF افزايش مي يابد. بر اساس اين تحقيقات اكنون روشن شده است كه بيماري هانتينگتون يك عارضه پيچيده است كه عملكرد و تكوين آن هنوز كامل نشده است، ژن هاي هانتينگتين جهش يافته نه تنها باعث توليد مواد سمي در مغز و از بين رفتن بافت عصبي مي شوند بلكه همچنين باعث مي شوند كه ماده مورد نياز رشد عصبي (BDNF) نيز به اندازه كافي در بافت مغز توليد نشود. البته ممكن است اين دو عامل با يكديگر ارتباط داشته باشند.
نجات مغز
اكنون كه درك ما از اين بيماري توسعه يافته تر شده است مي توانيم شيوه هاي درمان بهتري را انتخاب كنيم. داروهايي كه تاكنون براي مقابله با اين بيماري مورد استفاده قرار مي گرفته است تنها به آرام كردن برخي عوارض مي پرداخته و در عين حال عوارض جانبي فراواني داشته اند. در برخي از موارد، دارو يك جنبه از عوارض بيماري را اصلاح كرده ولي جنبه ديگر آن را بيشتر از قبل دچار صدمه مي كردند. پزشكان معمولا به اين بيماران آرام بخش تجويز مي كردند تا حركات ناخودآگاه آنان را كمي كنترل كنند وليكن اين دارو باعث كاهش ميزان دوپامين كه يك پيام رسان عصبي است گرديده و موجب افزايش ميزان افسردگي آنها مي شوند. براي مدت هاي طولاني در آمريكا و اروپا پزشكان، تحقيقاتي بر روي دارويي به نام ريلوزول (Riluzole) مي كردند كه تاثيرات ويژه آن ناشناخته است وليكن مي تواند برخي از عوارض بيماري هانتينگتون را از بين ببرد. شيوه هاي جديد مداوا نيز اخيرا به وجود آمده است. براي نمونه برخي از پزشكان بافت هاي تخريب شده مغز را برداشته و بافت هاي جديدي را به آن پيوند مي زنند. با اينكه فاكتور BDNF را به مغز تزريق مي كنند، عمل پيوند مغز نتيجه هاي خوبي داده است به ويژه اگر چنانچه در مراحل اوليه توسعه بيماري صورت گيرد، انجام اين عمل به لحاظ اخلاق پزشكي با مخالفت هايي روبه رو شده است چرا كه بافت مورد نياز از كشت جنين انسان به دست مي آيد. اخيرا يك پزشك فرانسوي عمل پيوند مغز را بر روي ۵ بيمار انجام داد كه در سه نفر از آنان توسعه قابل توجهي در حركات و همچنين قابليت هاي ذهني به وجود آمد. شيوه هاي جديد ديگر در تعداد بيشتري از بيماران مورد استفاده قرار مي گيرد. براي مقابله با مشكل اعتراضات اخلاقي در استفاده از مغز جنين هاي سقط شده اكنون پزشكان از بافت هاي كشت داده شده مغز استفاده مي كنند.
شيوه هاي ديگر درمان عبارت است از تزريق فاكتور نوروتروفيك سيلياري (Ciliary Neurotrophic) يا CNTF .تاكنون نشان داده اند كه اين فاكتور مي تواند مانع از مرگ حيوانات آزمايشگاهي شود كه به بيماري هانتينگتون مبتلا شده اند. وليكن در عمل مشكلاتي براي تزريق اندازه كافي اين ماده به مغز وجود داشته است. فاكتورهاي BDNF و CNTF اگر به صورت خوراكي به بيمار داده شوند تجزيه مي شوند. در برخي از موارد غشاهاي سلولي مانع ورود اين مواد به مغز مي شوند. اخيرا يك گروه از پزشكان سوئيسي از طريق ژن درماني روشي براي مقابله با اين بيماري به كار گرفته اند. آنها كپسول هاي محتوي سلول هايي را در مغزي كار مي گذارند كه مي توانند BDNF را به آرامي به مغز وارد كنند.
در حال حاضر پژوهشگران اميدوارند بتوانند دورنماي دارو درماني بيماري هانتينگتون را به داروهايي محدود سازند كه علاوه بر از ميان بردن تاثيرات سوء بيماري هيچ عوارض جانبي نيز به دنبال نداشته باشد. شايد با كشف اسرار بيماري هانتينگتون بتوان نسل آينده را به درمان قطعي اين بيماري اميدوار كرد.
Scientific American, Dec.۲۰۰۲




